Traditionelle klinische Studien finden an ausgewiesenen Studienorten statt. Prüfärzte und ihr Personal führen in der Regel die Verfahren für die Studie durch. Patienten innerhalb der klinischen Studie müssen den Studienort aufsuchen, um sich mit dem Personal zu treffen. Während sich die Technologie in allen Lebensbereichen weiterentwickelt, entwickelt sich auch die Gesundheitstechnologie weiter. Aus diesem Grund wurde der 21st Century Cures Act am 13. Dezember 2016 in das US-amerikanische Recht aufgenommen. Dabei hat die US-amerikanischen Food and Drug Administration (FDA) über einen Zeitraum von neun Jahren 500 Millionen US-Dollar zur Deckung der Implementierungskosten bewilligt. Was genau wird es Neues geben, was ist bereits da und was wird sich in Zukunft ändern?
Dezentrale klinische Studien (DCT) sind bereits eine bewährte Option für klinische Studien. Aus historischer Sicht, mit dem Fokus auf Regularien, haben diese einen langen Weg hinter sich. Es begann 2007 mit einem offiziellen Leitfaden, der Empfehlungen zur Verwendung computergestützter Systeme für klinische Untersuchungen, der von der FDA veröffentlicht wurde. Dieses Dokument ist die erste Grundlage zur Anwendung moderner Technologie in klinischen Studien.
Mobile Geräte und Biosensoren gewinnen an Bedeutung
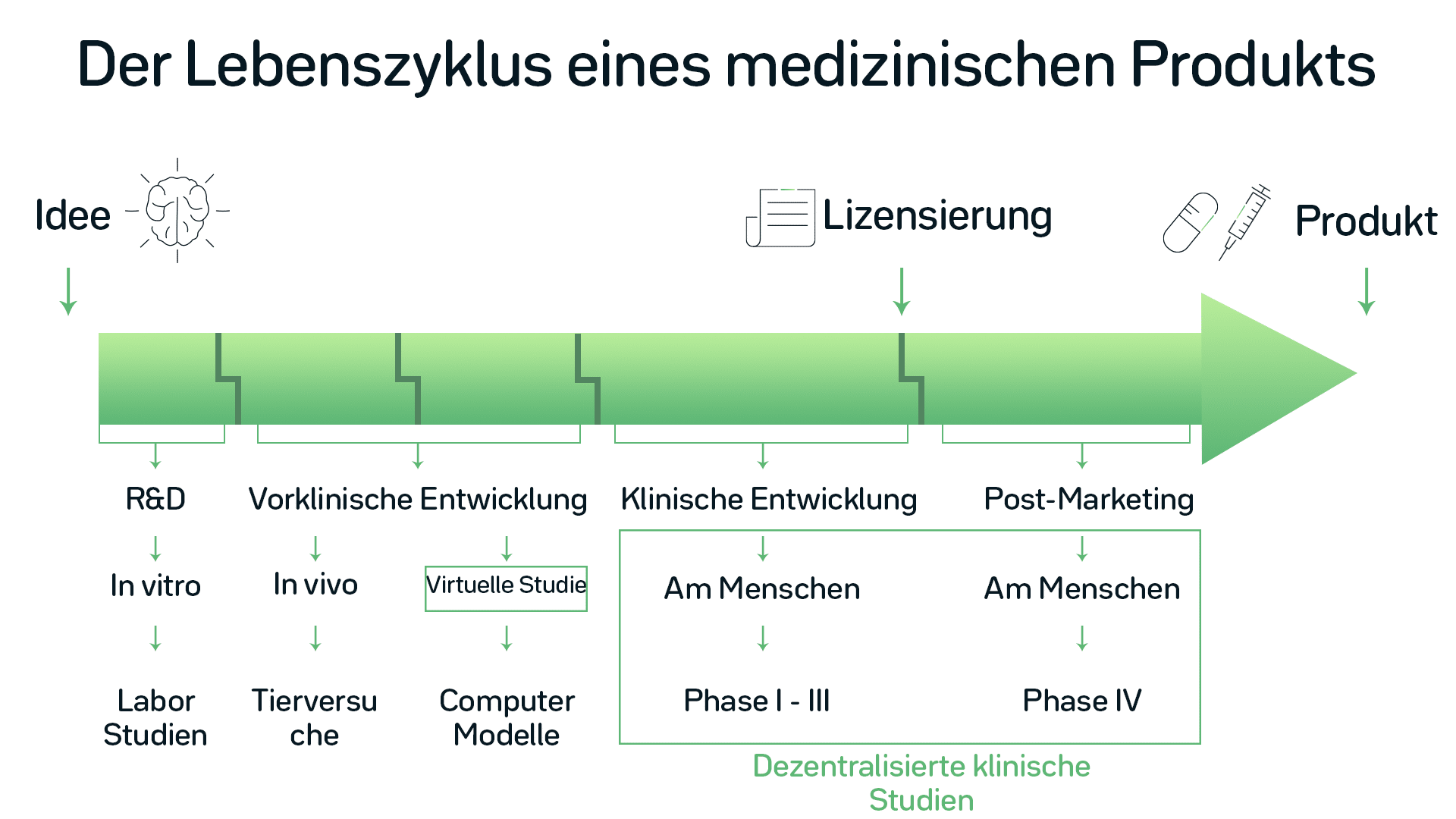
Der nächste Schritt erfolgte sechs Jahre später. Um klinische Untersuchungen zu modernisieren, wird in den Leitlinien für digitale Daten in klinischen Untersuchungen die Erfassung von Patientendaten in elektronischer Form gefördert. Es soll dabei helfen, die Zuverlässigkeit, Qualität, Integrität und Nachverfolgbarkeit von Daten von der Quelle bis zur elektronischen Einreichung sicherzustellen.
Die neueste Entwicklung ist der Leitfaden der FDA zur Verwendung von elektronischen Aufzeichnungen und E-Signaturen in klinischen Untersuchungen gemäß 21 CFR Part 11. Dieser wurde 2017 als Entwurf veröffentlicht. Das Papier beschreibt den Umfang und die Anwendung der Anforderungen von Part 11 für klinische Untersuchungen von Medizinprodukten. Außerdem wird das Thema der elektronischen Datenübertragung und die Protokollierung beim Gebrauch von elektronischen Geräten behandelt. Auch in Bezug auf die digitale Gesundheitstechnologie wurden einige Anstrengungen unternommen. Dazu gehört beispielsweise der Einsatz von mobilen Geräten und Biosensoren in klinischen Studien.
Als nächstes: Dezentrale klinische Studien
Die elektronischen Kommunikationstools, die Datenübertragung, die digitale Technologie und die Entwicklung auf dem Gebiet der Biosensoren sind erheblich fortgeschritten. Diese Entwicklungen eröffnen neue Möglichkeiten für den Informationsaustausch zwischen Prüfärzten vor Ort und Forschern im Institut. So werden Standorte unabhängig vom Wohnort des Prüfarztes werden als praktische Option für klinische Studien möglich.
Auch das Spektrum der klinischen Studien erweitert sich. Die klassische kontrollierte klinische Studie (CCT) ist nicht mehr die einzige Option. Das DCT ermöglicht es außerdem, eine ganz neue Patientengruppe zur Rekrutierung anzusprechen. Menschen, die ihre Häuser nicht verlassen oder nicht regelmäßig zu weit entfernten Studienorten reisen können, haben die Möglichkeit, an der medizinischen Forschung teilzunehmen. Dieser Ansatz erhöht nicht nur die Wahrscheinlichkeit für die Patienten, eine Heilmethode für ihre Krankheit zu finden, sondern führt auch zu zuverlässigeren, vielfältigeren und valideren Studienergebnissen. Als dritte Option stellen Hybridmodelle einen Mittelweg zwischen CCT und DCT dar.
Studien der Zukunft werden das bestehende Gesundheitsumfeld des Studienteilnehmers in sich integrieren. Die Integration maximiert den Komfort für die Studienteilnehmer. Außerdem werden bereits vorhandene Dienste und Datenquellen genutzt.
Ein relativ neuer Teil der DCT sind die sogenannten virtuellen klinischen Studien. In diesem Fall findet die gesamte Studie statt, ohne dass ein Prüfarzt beim Studienteilnehmer zu Hause vorbeikommt. Nach einer kurzen Einarbeitungsphase, in der ein „Site Concierge“ alle erforderlichen Technologien installiert und dem Studienteilnehmer erklärt, ist kein weiterer physischer Kontakt mit dem Studienpersonal erforderlich. Dies ist natürlich von Studie zu Studie unterschiedlich und kann nicht auf jede Studie angewendet werden.
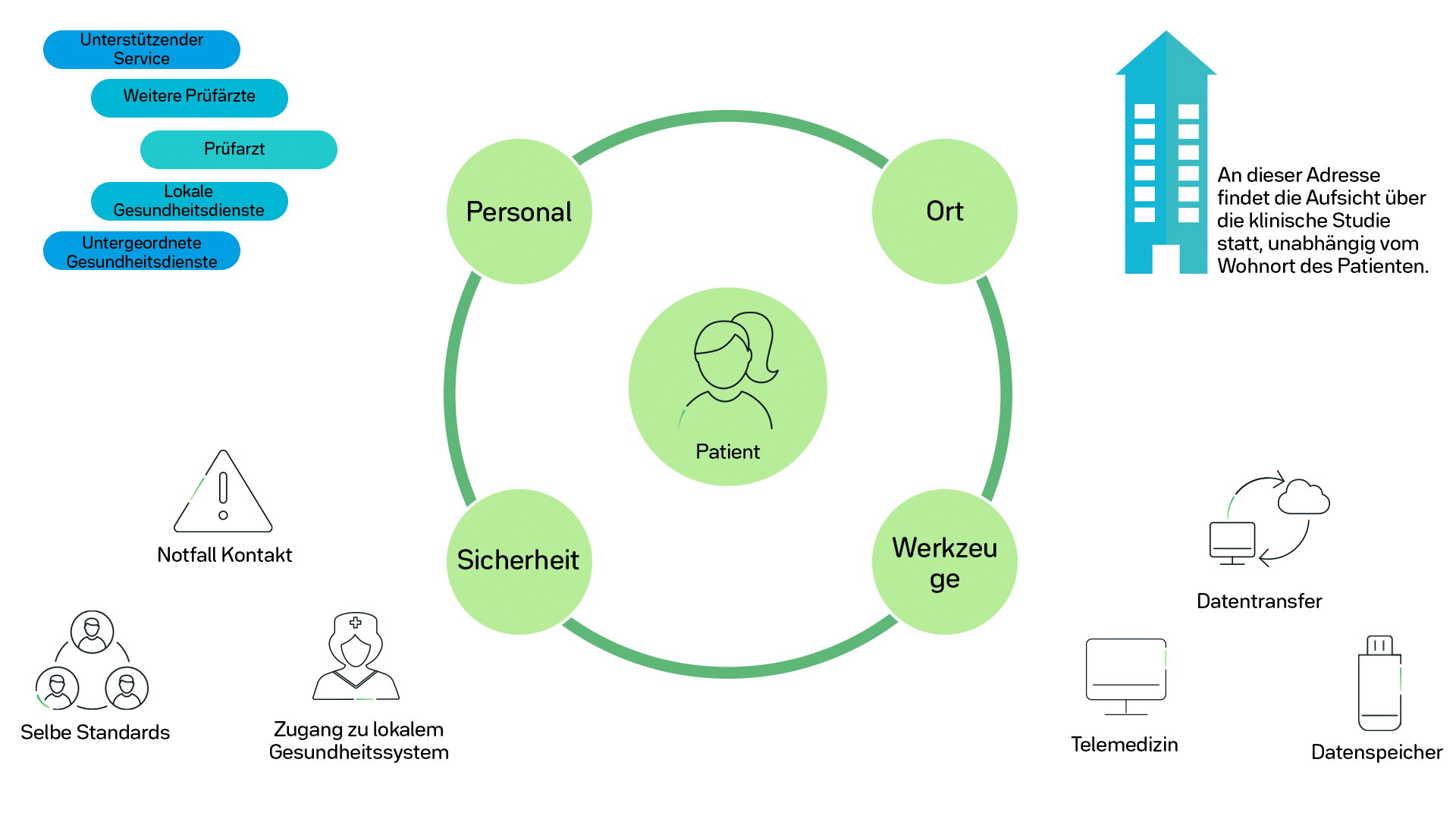
Werkzeuge und Vorschriften
Die Studienteilnehmer nutzen Videokonferenzen mit ihren Prüfärzten und verfügen über internetbasierte Tools für die Berichterstellung. Hinzu kommen mobile Technologie-Tools, einschließlich Biosensoren. Dieses Informationsnetzwerk sammelt eine Menge Daten, die für die verantwortlichen Prüfärzte und Forscher sofort sichtbar sind. Gleichzeitig werden lokale Gesundheitsdienstleister wie Apotheken, Kliniken und häusliche Gesundheitsdienste in die Erhebung von Daten zum Studienteilnehmer involviert.

Die Agentur [FDA] hat eng mit Interessenträgern zusammengearbeitet, einschließlich der Clinical Trial Transformation Initiative, um innovative Studiendesigns zu finden, die Rolle von dezentralen klinischen Studien und mobiler Technologie auszuarbeiten, und dabei zu helfen, neue Endpunkte zu validieren, die es Studien ermöglichen können, zuverlässige Beweise zu generieren, die benötigt werden, um Produktsicherheit und Wirksamkeit zu beurteilen. – Scott Gottlieb, damaliger FDA-Kommissar im März.
Die Apotheke wird zum Beispiel alarmiert, wenn dem Patienten die Medizin ausgeht. Berichte aus der häuslichen Pflege sind ebenfalls Teil der Datenerfassung und bieten tiefere Einblicke in das Wohlbefinden der Probanden. Mit Hilfe eines intelligenten Kühlschranks für die medizinische Versorgung kann die Einhaltung der Medikamenteneinnahme und Temperaturkontrolle jederzeit überwacht werden.
Die Regularien, die für DCT- oder Hybridmodelle klinischer Studien gelten, sind die gleichen, die bereits für klinische Studien gelten. Datenqualität und -integrität müssen alle gesetzlichen Vorschriften erfüllen. Die Sicherheit und Vertraulichkeit des Studienteilnehmers unterliegen ebenfalls den gleichen Bestimmungen.
